預測方向反應
簡介
預測方向反應是一個預測化學反應選擇方向的機率的過程,這樣做是為了一個非常重要的原因。該化學反應發生的位置決定了作為反應最終結果產生的材料的有效特性。專家可以透過進行一系列數學反應來預測結果。
化學反應
化學反應的過程被稱為一種產生某種反應物的方法。這是揮發性和非揮發性元素混合在一起的過程。在這個特定的混合物中,所有必要的因素,如溫度和密度都會發生變化,以改變特定反應的速度。變化要麼會大規模發生,要麼會以非常微小的方式發生。這就是為什麼在將所有這些元素和因素置於反應過程下後,它們將產生具有顯著特性的最終結果的原因。因此,這就是化學反應的全部含義,它們具有各種相關的屬性。
反應商和平衡常數
特定反應的商將保持在其常數點。每個人都有可能通過了解商上的總壓力來計算商。同樣,不同型別的反應物具有大量的重量,這些重量構成產物的整個分子質量。這與計算平衡常數的方式相同。唯一的區別在於,透過平衡計算得到的常數涉及產物的總分子量。在這裡,考慮了分壓和分子濃度,而不是元素的分子量。
計算平衡常數
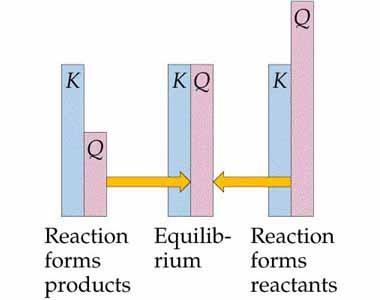
圖 1 - 反應平衡和商的表示
計算平衡常數的過程是透過使用常數產物來進行的。這就是為什麼當反應處於其常數狀態時,它們必須注意產物的平衡常數。所有這一切都能夠發生,當反應的平衡總是發現處於一個非常穩定的位置。所有這一切都能夠發生,當反應過程將其根植於特定位置時。這是確定分子總濃度用於計算平衡常數的過程的位置。
計算反應
計算反應的過程是為了得到反應發生的速率。有各種型別的方法用於計算此反應的過程。此反應的整個過程以反應發生的變化形式出現,這在化學品的幫助下發生。此計算的結果是透過除以可能發生的更改而得到的。此反應的被除數成為所有反應物在此反應過程中所花費的總時間。
計算反應商
當以這種反應形式陳述的點測量產物的化學濃度時,就會發生反應商。這些化學反應的數量發生在它們傾向於避免不在反應過程中的化學反應的時間。當所有這些分子的總濃度非常高時,此反應過程肯定會出現。
預測化學反應的方向
$\mathrm{Q_{c}\:>\:K_{c}}$,在這種情況下,反應透過向反應物達到平衡的方向移動而發生。
$\mathrm{Q_{c}\:<\:K_{c}}$,這是反應過程開始向產物達到平衡的一側滾動的時間。Qc = Kc,這是一種不試圖向前或向後移動的反應。這意味著反應過程處於平衡點。
這些是在化學反應過程中發現的三種預測。
結論
本教程重點介紹了定義反應傳遞方式的反應。這就是為什麼有一些部分解釋了化學反應的含義。因此,當預測環節得出結論時,某些化合物的生產商能夠決定化合物的有效性。
常見問題
1. 化學反應中的左右預測是什麼意思?
當某個化學反應過程發生時,反應物要麼會將反應劑新增到方程式中。當在平衡狀態下新增此試劑時,反應將向右側移動,即向產物側移動。另一方面,新增產物會使平衡向左移動。
2. KC 如何幫助預測化學反應的方向?
當 Qc > Kc 時,Qc 將下降以保持平衡。它們將根據 Kc 進行,這將確保反應的方向。
3. 化學反應如何說明它是可逆的?
化學反應的方向透過對所有情況都朝著不同的方向移動來說明它是可逆的。在可逆化學反應的情況下,它可以向任一方向發生。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 程式設計
C 程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP