DNA純度評估
介紹
DNA純度是指不含任何蛋白質、RNA或其他任何汙染物的DNA。即使在DNA提取後,仍然會殘留一些雜質,可以使用某些化學物質或酶將其去除。此步驟確保DNA的直接和下游應用的成功。
DNA純化
使用各種物理和化學方法裂解細胞,以從細胞核中釋放DNA。DNA提取後,細胞碎片以蛋白質的形式附著在其上,可以使用蛋白酶去除,或者直接從不純的DNA樣品中過濾掉。
進一步純化是透過使用異丙醇或乙醇等醇類沉澱DNA來完成的。DNA溶於水,因此無法分離,因此使用乙醇攪拌DNA並使用無菌移液管將其纏繞出來。此後,DNA懸浮在鹼性溶液中並使用。
DNA純化的重要性
純化很重要,因為它確保提取了研究工作所需的相同質粒或基因組DNA。
去除DNA中的碎片或汙染物可以延長DNA的儲存期,並降低研究工作中出現錯誤的可能性。
DNA純度評估方法
一般使用三種方法來評估DNA的純度:
吸光度法
熒光法
凝膠電泳
使用分光光度法的吸光度法
這是測試DNA純度和產量的最可靠方法。吸光度法測定純度所需的裝置包括:具有紫外燈的分光光度計、對紫外光透明的比色皿以及待測DNA樣品。
由於DNA在260nm波長處強烈吸收光線,因此吸光度讀數取為260nm或A260。此波長產生的數值允許估計含有DNA溶液的濃度。
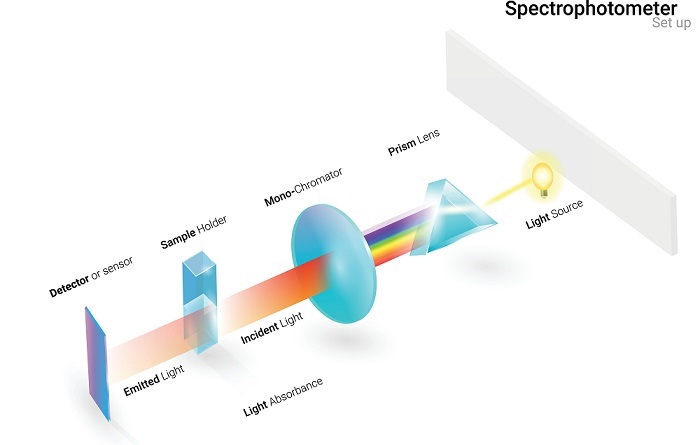
儀器中設定的線性範圍為0.1到1,用於獲得有用的數值。在320nm處測量DNA樣品的濁度。
樣品中DNA的濃度由以下公式給出:
DNA濃度(µg/ml) = (A260 - A320) × 稀釋因子 × 50µg/ml
DNA的產量可以透過濃度和樣品體積的乘積來測量。
DNA產量(µg) = DNA濃度 × 樣品體積 (ml)
但是,這種計算存在侷限性,不僅DNA,RNA也能在260nm處吸收紫外光。一些芳香族氨基酸,如酪氨酸、苯丙氨酸和色氨酸,也能在280nm處吸收紫外光,而胍在260nm處也有很高的吸收。由於所有這些原因,有時產量會被高估。
為了克服這一侷限性,透過測試230nm到320nm的純度來測試雜質的存在。最常用的純度計算是透過取260nm與280nm的比率來完成的。純DNA的值為1.7到2.0。低於1.7的值表示存在其他汙染物。純度計算公式如下:
DNA純度 (A260/A280) = (A260讀數 - A320讀數) ÷ (A280讀數 - A320讀數)
純DNA的首選值為大於1.5,小於該值表示濁度。
熒光法
與吸光度法相比,熒光法被認為更靈敏,可用於非常低濃度的DNA樣品。
此方法使用熒光DNA結合染料和稱為熒光計的儀器來檢查DNA的純度。與分光光度法相比,這些染料可提供更準確的結果。
一些常用的DNA結合熒光染料包括Pico Green、Quantiflour和Hoechst雙苯並咪唑,它們特異性地結合到雙鏈DNA上。
所使用的熒光計只有一個帶有微孔板的試管,樣品可以在PCR管、比色皿中讀取,這使得它成為檢測樣品中DNA純度和濃度的最便捷方法之一。
根據所選擇的染料,設定激發和發射值,計算未知值的濃度並與已知值進行比較。
此方法的唯一侷限性是熒光化合物的猝滅和光漂白效應會改變訊號。
凝膠電泳
另一種用於測試濃度和純度的方法是瓊脂糖凝膠電泳。
此方法根據電荷和大小分離DNA。由於DNA帶負電荷,它將向帶正電的陽極移動,DNA分子越小,移動速度越快。
製備瓊脂糖凝膠的百分比也決定了可以用其分離的尺寸範圍。與以不同速率移動的RNA或蛋白質相比,形成的DNA條帶是清晰的。
可以透過將DNA條帶的強度與標準DNA進行比較來確定濃度,並使用嵌入染料溴化乙錠來觀察DNA。
結論
在研究中,在將分離的DNA樣品用於分析過程之前,質量指標顯示其質量和可用性。這裡的質量指標是DNA樣品的完整性和純度。純度在很大程度上決定了研究的成功;因此,DNA樣品應不含任何蛋白質等汙染物。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP