分子間力的不同型別
引言
分子間力是構成所有分子間相互作用的基礎力。這些相互作用比分子內力弱。分子間吸引力 (IMF) 的強度決定了兩種分子之間將發生的相互作用型別,以及這些相互作用將引起的改變。在考慮分子間吸引力 (IMF) 時,最常見的參考是水 (H₂O) 分子。分子間力 (IMF) 決定物質的物理特性。此外,水 (H₂O) 是少數幾種可以同時存在於三種狀態(固態、液態和氣態)的化合物之一。
什麼是分子間力?
“分子間力 (IMF)”一詞指的是原子之間的靜電力 (EF) 吸引甚至排斥,因為形容詞“inter”意味著“在…之間”。另一種用於形成分子的原子之間存在的力的說法是“分子內力”。例如,“國際的”和“國際的”分別指的是兩個或多個國家之間的相互作用。分子間力 (IMF) 是原子之間存在的力。這些力包括偶極-偶極 (d-d) 相互作用、離子-偶極 (I-d) 相互作用、離子-誘導偶極 (I-Id) 相互作用、範德華力 (VDW),包括氫 (H) 鍵。這些力是計算物質的物理特性(如密度、焓、熔點 (M.P.)、沸點 (B.P.)、汽化等)所必需的。IMF 比分子內力(如離子鍵或共價鍵)弱得多。

分子間力的不同型別是什麼?
它們大致分為三種類型——範德華力 (VDW)、偶極-偶極 (d-d) 相互作用和氫鍵。然而,指的是倫敦色散力 (LDF) 的誘導偶極子的說法,被進一步分類。這導致了五種不同的分子間力 (IMF) 形式。
偶極-偶極力 (d-d 力)
離子-偶極相互作用 (I-d 相互作用)
離子-誘導偶極相互作用 (I-Id 相互作用)
範德華力
氫鍵
偶極-偶極相互作用
這種型別的相互作用是由化合物之間的部分正電和負電側引起的。分子的負電側吸引其他分子的正電側,導致形成稱為分子間偶極-偶極相互作用的靜電力 (EF) 吸引。這種型別的靜電吸引比離子-離子接觸弱。由於偶極相互作用基於部分電荷,因此離子相互作用基於被稱為陽離子和陰離子的永久正電荷和負電荷。

鹽酸 (HCl) 相互作用是偶極-偶極力的例子。H 原子部分帶正電,而 Cl 原子部分帶負電。當部分帶負電的 Cl 原子吸引來自相鄰分子的部分帶正電的氫 (H) 時,就會產生一個大型的類似連線網路。氫化硫 (H₂S)、二氧化氮 (NO₂)、水 (H₂O)、二氧化硫 (SO₂)、EDTA(乙二胺四乙酸)、氨 (NH₃) 和其他極性分子是唯一可以發生偶極-偶極相互作用的分子。這些相互作用受極性分子特性的影響。
離子-偶極相互作用
當離子與極性化合物相互作用並形成相互作用力時,就會產生這些相互作用。極性分子具有部分正電荷和負電荷,因此當帶有正電荷或負電荷的離子接近它們時,它們之間會產生靜電力 (EF)。由於相反的電荷相互排斥而相似的電荷相互吸引,因此離子總是被吸引到極性化合物相反帶電的一端。
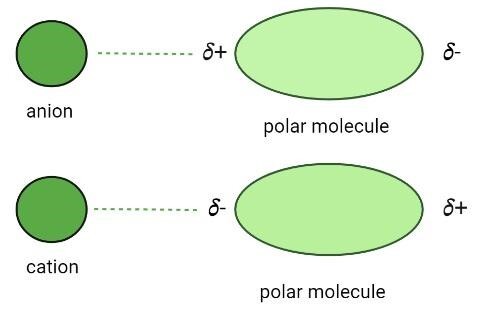
當氯化鈉 (NaCl) 加入水中時,水 (H₂O) 分子與鈉離子和氯離子結合。水透過離子-偶極相互作用將離子物質分解成離子的能力被稱為水合作用。
離子-誘導偶極相互作用
離子控制離子-誘導相互作用。當離子接觸非極性物質時,它會導致物質產生部分正電和負電極,將其轉化為偶極構型。換句話說,離子在非極性分子上產生偶極矩,導致它們變成極性分子。金屬離子接近氧 (O) 和其他分子並導致其中產生淨偶極矩是這種相互作用的例子。
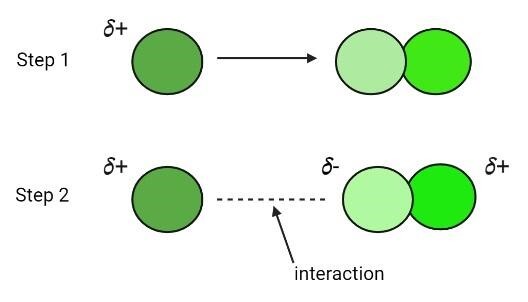
如果使用離子產生偶極子,則產生的力被稱為離子-誘導偶極相互作用。但是,如果這些相互作用發生在現有的極性分子和非極性分子之間,則它們被稱為偶極-誘導偶極相互作用。例如 (NO⁻),
結論
IMF 是物質之間存在的吸引力和排斥力。它們是分子和原子之間存在的靜電力。各種物質的沸點 (B.P.) 與它們的分子間力 (IMF) 有關。最弱的力是倫敦力或色散力。與偶極-偶極相互作用一樣,離子-偶極相互作用發生在離子與極性原子之間。
常見問題解答
1. 為什麼液體的粘度隨著溫度的升高而降低?
這樣,在高溫下,物質的分子獲得高動能,但可以克服分子間相互作用,在各層之間相互滑動,液體的粘度降低。
2. 晶體的熔點 (M.P.) 的大小反映了它的穩定性。解釋一下?
固體的熔點 (M.P.) 描述了在物質組分之間起作用的分子間力。當這些力很大時,組分的熔點較高;當這些力低時,組分的熔點低。固體的熔點越高,它就越穩定。
3. 在熔融狀態或水溶液中,離子固體是良好的導體,但在固態下不是。為什麼?
由於結構堅硬和靜電力強,離子固體中的離子在固態下不能自由移動。因此,它們在熔融時不能導電,但在水溶液中,離子可以自由移動,從而導電。
4. 哪些力導致液體的粘度?是什麼導致甘油比水 (H₂O) 粘度更大?
導致液體粘度的力包括氫 (H) 鍵和範德華力 (VDW)。甘油比水 (H₂O) 粘度大得多,因為甘油的原子由於其中存在三個醇基而比水的原子具有更多的氫鍵。
5. 晶體的熔點 (M.P.) 的大小反映了它的穩定性。使用資料手冊,收集固態水、乙醇、乙醚和甲烷的熔點 (M.P.)。關於這些分子的分子間力 (IMF) 可以說些什麼?
物質的熔點 (M.P.) 越高,其分子間吸引力越強,穩定性越好。熔點 (M.P.) 較高的物質比熔點 (M.P.) 較低的物質更穩定。
乙醚 = -116.3°C
甲烷 = -183.81°C
固態水 = -0.15°C
乙醇 = -114.35°C
根據所提供組分的數值,固態水中的分子間力 (IMF) 最高,而甲烷中的最低。


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP