darmstadtium (鐽)
介紹
鈩是一種人工合成的元素。門捷列夫預見了它的存在,並將其命名為類鉑,後來改為110號元素。它於1994年由Peter Armbruster和Gottfried Munzenberg在德國GSI亥姆霍茲重離子研究中心被發現。其元素符號為Ds。鎳(Ni)同位素轟擊鉛(Pb)同位素,產生了269Ds的一個原子。使用相同技術,透過轟擊鎳離子,產生了9個271Ds原子。該元素以發現它的德國城市達姆施塔特命名。

關於鈩的事實
鈩是最新發現的元素之一,於1994年11月9日在德國的一個研究實驗室合成。
一個德國研究小組分離出了1個Ds原子,該小組還發現了107號到109號元素。
在鈩被發現之前,元素週期表中它的位置被ununnilium (Uun)佔據。
IUPAC於2003年正式分配了它現在的名稱。
透過該方法幾乎只產生過幾個原子。
該元素是第7週期10族元素的一部分,屬於d區過渡金屬。
尚未證實,但Ds被認為與鉑(Pt)的性質相似。
它被認為具有類似於鎳(Ni)、鈀(Pd)和鉑(Pt)的性質。
Ds 元素
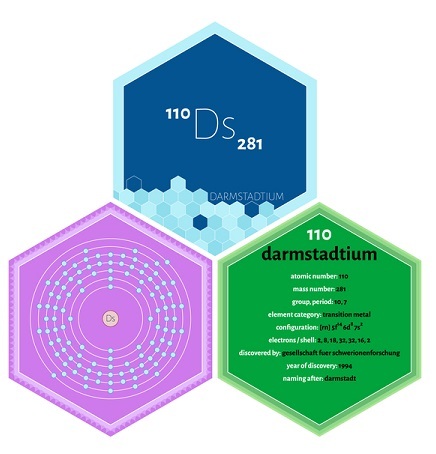
該元素的原子序數(Z)為110,是人工合成的。因此,在化學中也稱為110號元素。在元素週期表中,Ds代表其化學符號。Ds具有極強的放射性,並且自然界中極其稀少。這種物質具有獨特的物理和化學性質。
鈩的物理性質
| 性質 | 數值 |
|---|---|
| 原子序數 (Z) | 110 |
| 化學符號 | Ds |
| 沸點 (B.P.) | 未知 |
| 族 | 10 |
| 週期和區 | 7 - d |
| 狀態 | 在20℃下為固態,屬於過渡金屬。 |
| 電子構型 | Rn 5f146d97s1 |
| 顏色 | 未知 |
| 熔點 (M.P.) | 未知 |
| 密度 | 34.8 g/cm³ |
| 晶體結構 | 體心立方 (BCC) |
鈩的化學性質
Ds是一種放射性元素,存在於人工合成的環境中。它的化學性質仍在被完全研究中。由於同位素的半衰期極短以及其配合物的揮發性極強,需要進行具有統計意義的化學研究。當該元素與氟(F)結合時,會形成六氟化鈩,形成揮發性較低的配合物。
| 性質 | 數值 |
|---|---|
| 電離能 | 960 kJ/mol |
| 氧化態 | 0, +2, +4, +6, +8 |
| 毒性 | 由於其極不穩定的特性,任何生成的量都會迅速衰變為其他元素。因此,其對健康的的影響尚不清楚。 |
製備
在製備過程中,反應是透過在重離子加速器中用鎳(Ni)-62的快速原子核轟擊鉛(Pb)-208原子進行的。該小組製備了單個269Ds同位素原子。
$$ \mathrm{Pb-208 + Ni-62 \rightarrow Ds-269 + ^1_0n} $$
在這個對比測試系列中使用了較重的鎳離子Ni-64,經過兩次執行後,該小組能夠製備9個271Ds原子。
$$ \mathrm{Pb-208 + Ni-64 \rightarrow Ds-271 + ^1_0n} $$
同位素
該元素有9種不同的同位素。由於它是一種人工合成的元素,因此沒有一種同位素是穩定的。同位素是透過較重元素的衰變或兩種輕原子核的聚變產生的。較重的同位素比較輕的同位素更穩定。所有同位素都透過α衰變或自發裂變衰變,沒有同位素透過β衰變衰變。
| 半衰期 | 同位素 |
|---|---|
| 6.7 ms | Ds-280 |
| 10 μs | Ds-267 |
| 12.7 μs | Ds-281 |
| 240 μs | Ds-273 |
| 205 μs | Ds-270 |
| 3.5 ms | Ds-277 |
| 0.21 s | Ds-279 |
| 230 μs | Ds-269 |
| 90 ms | Ds-271 |
鈩的電子構型
電中性原子具有與質子數相同的電子數(e⁻)。因此,Ds的中性原子有110個電子(e⁻)。原子中+核電荷以及其他(Z-1)個-電子(e⁻)產生的電場(e.f.)影響每個電子(e⁻)。
原子序數(Z)識別不同的化學元素,因為電子數及其排列負責原子的化學行為。這些電子的排列由量子力學原理決定。各個元素電子殼層中的電子數,特別是最外層的價電子殼層,決定了它的化學鍵合行為。元素週期表中元素的排列是按原子序數排列的。
電子構型 - Rn 5f146d97s1
1s22s22p63s23p63d104s24p64d105s25p64f145d106s26p65f146d97s1
每殼層電子數 - 2, 8, 18, 32, 32, 16, 2
結論
元素“鈩”的名字來源於德國城市達姆施塔特,在那裡它被發現。該元素不是天然產生的,而是在研究實驗室中合成的。它由Peter Armbruster和Gottfried Münzenberg在Sigurd Hofmann的指導下在德國被發現。鈩有九種已知的同位素,所有這些同位素都具有極強的放射性。281-Ds同位素是所有已知Ds同位素中最穩定的,半衰期僅為12.5秒。
常見問題
1. Ds的環境影響是什麼?
由於其短暫的生命週期,該元素會在幾秒鐘內衰變為其他元素。因此,它不會對環境造成危害。
2. Ds元素的重要性及其應用是什麼?
Ds及其同位素在實驗室環境中使用。它通常用於化學方面的科學研究。由於其放射性和短半衰期,Ds沒有商業應用。
3. 鈩的健康危害是什麼?
因為它非常不穩定,任何生成的量都會如此迅速地衰變為其他元素,以至於研究它對人體健康的影響毫無意義。Ds具有高放射性,必須小心處理。
4. 最長的穩定的Ds同位素是什麼?
Ds-281是該元素最長的穩定同位素,半衰期約為12.7秒。
5. 關於鈩的質子和中子的資訊?
Ds是一種原子序數(Z)為110的元素,表示其原子核包含110個質子。原子核中質子的數量稱為原子序數。因此,原子核的總電荷為+Ze,其中基本電荷對應於1.602 × 10⁻¹⁹庫侖。
原子核中中子的數量稱為原子的中子數,用符號N表示。中子數和原子序數(Z)之和等於原子質量數(A):N + Z = A。中子過量定義為中子數和原子序數之差:D = N - Z = A - 2Z


 資料結構
資料結構 網路
網路 關係資料庫管理系統 (RDBMS)
關係資料庫管理系統 (RDBMS) 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C語言程式設計
C語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP