電導滴定法
簡介
電導滴定法是一種利用電導儀進行化學反應的滴定方法。與其他滴定方法一樣,需要使用指示劑來確定終點;在這裡,使用電導儀來找到反應的終點。其原理是透過反應混合物中一個離子取代另一個離子。溶液中離子的這種交換有助於測量電導率的變化。這些變化有助於達到終點,從而表明反應已完成。這種利用電導儀確定終點的滴定方法稱為電導滴定法。
什麼是電導滴定法?
它是用於測定樣品濃度的定性化學分析方法之一。
在這種滴定中,電解質電導率的增加或減少是由於反應混合物中離子濃度的變化引起的。
在這種滴定中,電導率的測量作為一種工具來尋找終點。
因此,這種滴定有助於利用電導率測量來確定滴定的終點,稱為**電導滴定法**。
電導滴定法中使用的術語
使用的術語如下:
**滴定劑** - 指濃度已知的溶液。它是一種標準溶液,新增到濃度未知的另一種溶液中。
**分析物** - 指濃度未知的溶液。
**終點或等當點** - 指滴定過程中電導率發生突然變化的點。換句話說,將必要的反應物新增到溶液中以**完成反應**。
**電導率 (G)** - 定義為電阻 (R) 的倒數。換句話說,電導率越高,電阻越小,電流越容易流動。
$$\mathrm{G=\frac{1}{R}}$$
原理
電導滴定法的原理是:
“一個離子被另一個離子交換,這些離子的離子電導率差異直接影響溶液的總電解質電導率。”
此外,它是一個體積過程,依賴於滴定過程中反應混合物或樣品**“電導率”**的測量。滴定中發生的電導率可以用歐姆定律來解釋,歐姆定律指出,流過導體的電流 (i) 與電位差 (V) 成正比,與電阻 (R) 成反比。
$$\mathrm{i=\frac{V}{R}}$$
其中 V= 電位差
i= 電流
R= 電阻
因此,以上所有因素 V、i 和 R 都取決於:
離子的遷移率。
自由離子的數量和電荷(正或負)。
溫度。
理論
在這種型別的滴定中,終點通常透過電解質電導率來測量。例如,當我們進行酸鹼滴定(中和反應)時。最初,溶液的電導率降低。然後,溶液的電導率會突然增加。這種電導率的增加或減少是由於反應混合物在反應前後離子差異造成的。這種差異有助於產生終點。為了計算這種反應的終點,繪製了一個圖表。以下是所示圖表:
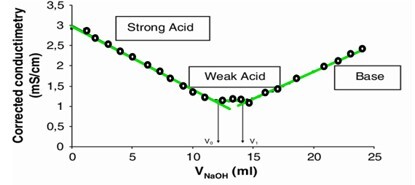
解釋
此圖基於酸鹼滴定,當 NaOH(滴定劑)不斷新增到酸溶液中時,它用鹼的陽離子部分取代 H^+ 離子。從而使酸溶液中的 H^+ 離子持續減少,這也降低了電導率。當所有離子都被交換並且只有滴定劑離子(OH^-)可用於導電時,就會達到一個點。滴定劑離子濃度的增加會增加電導率。電導率的突然變化有助於確定終點。當在**電導率與滴定劑體積**的圖中繪製觀察到的電導率和滴定劑值時,它將給出兩條具有相反斜率的直線。這兩條線進一步在一個稱為終點的點處相交。
過程
為了進行這種滴定,需要遵循以下步驟:
收集所有裝置,例如滴定管、滴定管架、燒杯和連線到電導儀的電導池。
首先,用鹼充滿滴定管並記錄其初始體積。
然後,製備分析物,例如用蒸餾水稀釋的酸。
現在,將電導池(應正確浸入)插入此分析物或稀釋的酸溶液中。然後將此池連線到電導儀並準備好記錄讀數。
現在,將鹼逐滴新增到分析物或酸溶液中。
必須記錄電導率的變化以及鹼的記錄。它顯示出電導率最初降低。
新增更多幾滴後,它顯示出反應混合物或溶液的電導率突然增加,因為離子濃度增加。
最好再進行一些讀數以找到正確的終點。
最後,繪製觀察值的圖形。此繪製的圖形有助於從兩條線的交點找到等當點或終點。
電導滴定法的優缺點
一些優點是:
它不需要任何指示劑,因為電導率的變化由電導儀測量。
它適用於各種型別,例如有色溶液、稀溶液和渾濁溶液。
其終點是透過圖形獲得的,因此它可以獲得更好的結果,誤差最小。
它沒有溫度問題,因為它在整個滴定過程中保持恆定。
一些缺點是:
它不能保證提供 100% 的準確性,因為該過程不允許新增少量滴定劑的增加。
由於滴定過程中形成的沉澱物的緩慢分離以及離子在沉澱物上的吸附,因此它在沉澱反應中表現不佳。
它也僅限於氧化還原反應,因為溶液中高濃度的水合氫離子 (H_3 O+) 往往會掩蓋電導率的變化。
電導滴定法的應用有哪些?
電導滴定法的各種應用有:
用於檢查湖泊和河流中的水汙染。
用於追蹤食物中的微生物。
用於估算糖汁中的灰分含量。
用於確定水的純度和水的去離子化。
用於檢測水中氘離子濃度。
用於追蹤抗生素。
結論
電導滴定法是一種利用稱為電導儀的裝置來確定物質濃度的滴定方法。該裝置包含一個電導池,該電導池應該插入溶液(未知強度或濃度)中。它測量溶液中離子濃度的變化。離子濃度的差異顯示出電導率的增加或減少。電導儀記錄這些電導率的總體變化。因此,然後將這些記錄的值繪製在圖表上,這有助於確定終點或等當點。滴定中的此終點表示反應的完成。
常見問題
1. 電導法中使用哪種電極?
電導法中使用的電極是電導池,由石英或派熱克斯玻璃製成。它由兩個鉑製成的電極組成,必須放在水容器中以保持其恆溫。
2. 為什麼電導法不用直流電?
如果使用直流電,會導致電解並隨時間推移改變溶液的濃度。因此,最好使用交流電而不是直流電。
3. 在電導滴定中,電導率何時降低?
在酸鹼滴定中,鹼用其陽離子部分取代酸溶液的 H+ 離子,從而降低 H+ 離子的濃度。這種濃度的降低降低了溶液的電導率。
4. pH 值是否會影響電導滴定中的電導率?
pH 值透過氫離子濃度決定物質的酸鹼性,而電導率則取決於自由電子的存在。pH 值和電導率之間沒有關係。
5. 為什麼電導池用於電導滴定?
電導池連線到電導儀,浸入溶液中,有助於測量反應混合物中離子濃度的連續變化。因此,可以獲得各種有助於確定反應終點的資料。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 語言程式設計
C 語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP