硼
簡介
第 13 族(III A 族)的元素包括硼 (B)、鋁 (Al)、鎵 (Ga)、銦 (In) 和鉈 (Tl)。由於存在三個價電子,這些元素也被稱為類金屬和三價金屬。硼的外層電子構型可以寫成 $\mathrm{1s^2\:2s^2\:2p^1}$。在接下來的章節中,我們將討論硼的出現、物理和化學性質。
硼的發現和提取
硼是一種相對不常見的元素,約佔地殼的百萬分之九 (ppm)。戴維最初於 1807 年透過將硼酸與鉀熔化而分離出該元素。它主要以硼砂 $\mathrm{(Na_2B_4O_7.10H_2O)}$ 和硼酸 $\mathrm{(H_3BO_3)}$ 的濃縮礦床形式存在,並且不存在於遊離狀態。硼鎂石 $\mathrm{(2Mg_3B_3O_{15}.MgCl_{2})}$、硬硼鈣石 $\mathrm{(Ca_2B_6O_{11}.5H_2O)}$、硼鈉鈣石 $\mathrm{(Ca_2B_4O_7.NaBO_2.8H_2O)}$ 和曲晶硼砂 $\mathrm{(Na_2B_4O_7.4H_2O)}$ 是一些其他值得注意的礦物。
硼的物理性質
電離能
由於 p 電子比 s 電子結合得鬆散,因此 III A 族元素的第一電離能低於 II A 族元素。硼的前三個電離能的值如表所示。與第一電離能相比,第二和第三電離能更高。正如預期的那樣,硼具有最大的電離能值。
| 元素 | $\mathrm{IE_1}$ | $\mathrm{IE_2}$ | $\mathrm{IE_3}$ | $\mathrm{IE_1 + IE_2 + 1E_3}$ |
|---|---|---|---|---|
| 硼 | 801 | 2427 | 3659 | 6887 |
氧化態
硼在其所有化合物中的氧化態為 (+III)。其他元素的氧化態為 (+I)。(+III) 態的穩定性隨著向下移動而降低,而 (+I) 態的穩定性則提高。
化合物的性質
由於其小的離子尺寸和高的電離能,硼形成高度共價的化合物。由於同樣的原因,硼是一種典型的非金屬。
結構、熔點和沸點
硼具有有趣的二十面體結構,其中 $\mathrm{B_{12}}$ 作為基本單元。除鎵外,其他元素都具有緊密堆積的金屬結構。因此,B 的熔點和沸點相當高。
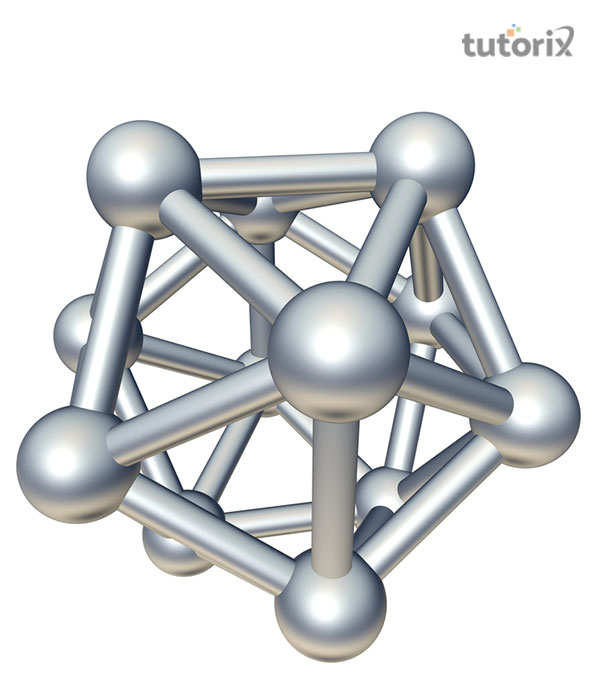
圖 1:二十面體 B12 單元
硼和矽之間的對角線關係
同素異形體:這些元素都存在無定形和結晶形式。
存在:這兩種元素在自然界中僅以化合物的形式存在。它們不會自由存在。
金屬特性:由於它們的電離能高,這兩種元素都是非金屬和絕緣體。
密度和熔點:這些元素的特徵是密度低和熔點高。
化合物的性質:由於它們的電離能高,它們形成共價配合物。
氧化物和含氧酸:這兩種元素都在空氣中燃燒生成氧化物,氧化物微溶但熔點高。氧化物非常穩定,並且只有輕微的酸性。當氧化物溶解在水中時,會產生弱酸。
$$\mathrm{H_3BO_3 + 2H_2O\:\rightarrow\:H_3O^+ + [B(OH)_4]^–}$$
$$\mathrm{H_4SiO_4 + 2H_2O\:\rightarrow\:H_3O^+ + [Si(OH)_5]^–}$$
硼的化學性質
與空氣和水的反應
硼在其純結晶狀態下反應性很低,但在其細分散的無定形狀態下反應性很高。當在空氣中加熱時,它會產生 $\mathrm{B_2O_3}$,在極高溫度下會生成 BN。它不與 $\mathrm{H_2O}$ 反應。
$$\mathrm{4B+3O_2\:\rightarrow\:2B_2O_3}$$
$$\mathrm{2B + N_2\:\rightarrow\:2BN}$$
與酸和鹼的反應
無定形硼會還原熱的濃硫酸和硝酸。
$$\mathrm{B + 3HNO_3\:\rightarrow\:H_3BO_3 + 3NO}$$
$$\mathrm{2B + 3H_2SO_4 \:\rightarrow\:2H_3BO_3 + 3SO_2}$$
硼從熔融的苛性鹼中釋放出 $\mathrm{H_2}$,導致形成硼酸鹽
$$\mathrm{2B + 6NaOH\:\rightarrow\:2Na_3BO_3 + 3H_2}$$
與氨的反應
除硼外,所有金屬都與 $\mathrm{NH_3}$ 反應生成醯胺,硼在極高溫度下與 $\mathrm{NH_3}$ 反應生成氮化物。
$$\mathrm{2B + 2NH_3\:\rightarrow\:2BN + 3H_2}$$
硼的用途
硼用於生產高強度鋼。
硼用作銀焊和銅焊中的助熔劑。它還用於製造洗滌劑和玻璃纖維。
硼矽酸鹽玻璃由硼的氧化物製成。
硼是一種高效的還原劑
$$\mathrm{3CO_2 + B\:\rightarrow\:2B_2O_2 + 3C}$$
$$\mathrm{3\:SiO_2 + 4B\:\rightarrow\:2B_2O_3+ 3Si}$$
結論
1808 年,法國科學家約瑟夫·路易·蓋-呂薩克和路易·雅克·泰納爾透過加熱氧化硼 $\mathrm{(B_2O_3)}$ 和鉀金屬發現了硼,英國化學家漢弗萊·戴維也獨立發現了硼。
硼是元素週期表中 III A 族的一員。純結晶硼是黑色、有光澤的半導體,在高溫下像金屬一樣導電,但在低溫下則表現為近乎絕緣體。
常見問題
Q1. 說明硼和矽之間的相似之處。
答:硼和矽之間的相似之處如下
(i) 這兩種元素在自然界中僅以化合物的形式存在。它們不會自由存在。
(ii) 這些元素都存在無定形和結晶形式
(iii) 由於它們的電離能高,這兩種元素都是非金屬和絕緣體。
Q2. 硼如何與鹼反應?
答:硼透過從熔融的苛性鹼中釋放氫來生成硼酸鹽。
$$\mathrm{2B + 6NaOH\:\rightarrow\:2Na_3BO_3 + 3H_2}$$
Q3. 說明一種製備硼的方法。
答:將三氧化二硼在高溫下用 Na、K 或 Mg 粉末還原。用強鹽酸煮沸硼以溶解氧化鎂後,會生成無定形狀態的深棕色硼。
$$\mathrm{B_2O_3 + 6K\:\rightarrow\:2B + 3K_2O}$$
$$\mathrm{B_2O_3 + 3Mg\:\rightarrow\:2B + 3MgO}$$
Q4. 硼的物理性質是什麼?
答:硼的物理性質如下
(i) 硼是一種非金屬元素,熔點為 2453 攝氏度,但在 1873 攝氏度時會揮發。
(ii) 其比重為 2.34,無定形狀態下為棕色。
(iii) 其結晶形式非常耐用且耐熱,比重為 3.3。
Q5. III A 族元素的一般外層電子構型是什麼?
答:III A 族元素的一般外層電子構型為 $\mathrm{ns^2\:np^1}$。


 資料結構
資料結構 網路
網路 關係型資料庫管理系統
關係型資料庫管理系統 作業系統
作業系統 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 語言程式設計
C 語言程式設計 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP